产品概述
| 产品描述 | 本试剂盒基于分子排阻色谱原理,根据被分离组分分子大小差异进行外泌体的分离。具有操作简便、高纯度和高回收率等优点,特别适用于大体积样本中的外泌体分离。分离的外泌体可用于WB分析、NTA或纳米流式粒径分析、电镜检测、组学研究、细胞和动物功能研究等。 |
| 分离方法 | 尺寸排阻色谱法(SEC) |
| 产品优势 | 1. 样本体积兼容范围广 0.1-3 mL样本体积都兼容; 2. 纯化外泌体纯度高 可直接用于鉴定检测或外泌体示踪和功能研究等; 3. 操作简单 重力柱模式无需专业的纯化设备,对场地设备要求少,时间短; 4. 回收率高 可自由选馏分管蛋白污染程度低,分离出的组分无蛋白污染。 |
| 运输条件 | 冰袋运输 |
| 保存条件 | 2-30℃或2-8℃,避光保存 |
| 保质期 | 18个月 |
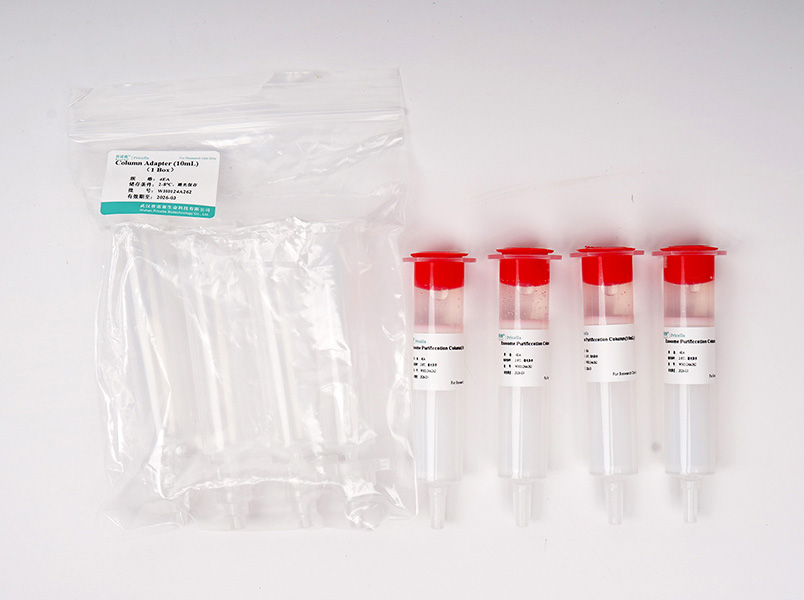
产品组分
| 规格 | 组分名称 | 含量 | 保藏温度 |
| 3Tests | Exosome Purification Column (30 mL) | 3Tests | 2-8℃ 避光保存 |
| 3Tests | Column Adapter (30 mL) | 3Tests | 2-30℃ 避光保存 |
自备仪器耗材
使用方法
1. 样品预处理
1) 去除细胞。4℃,300 g,离心5 min,转移上清到新的离心管;
注意:对无细胞的样品,可以跳过此步骤。
2) 去除细胞及细胞碎片。4℃,2000 g,离心10 min,转移上清到新的离心管;
3) 去除大体积颗粒。步骤 2)得到的上清,4℃,14000 g,离心30 min,转移上清到新的离心管。
2. 纯化柱预处理
1) 提前将纯化柱(Exosome Purification Column (30 mL))安装在纯化柱固定器(Purification Column Stand)上,纯化柱下面放置废液槽。放置于室温30 min以上,恢复室温;
注意:纯化柱需充分平衡至室温(18-25℃),温度过低或过高,都会影响外泌体分离效果。
2) 检查纯化柱下端是否充满液体。如果纯化柱下端无空气,可以跳过该步骤;若纯化柱下端存在空气,将纯化柱倒置,打开下端密封帽,用移液器或注射器取水或20%乙醇顶出空气,在密封帽中充满水或20%乙醇,再盖上密封帽,放回固定器上;
3)先打开纯化柱顶盖,再打开下端的密封帽,弃去纯化柱上的封柱液(可直接倒掉或者用移液器吸取),向纯化柱中加入 6 mL PBS 备用。将适配器(Column Adapter (30 mL))与纯化柱连接,并从顶部加入加2倍柱体积(60 mL)PBS平衡纯化柱,至下方没有溶液流出。清洗过程中,纯化柱的顶部筛板必须始终保持湿润。冲洗完成后,盖上底端密封帽,断开适配器,加入3 mL PBS备用。
a. 注意要先打开纯化柱上盖,再打开下端的密封帽,否则空气将进入纯化柱中,影响外泌体分离效果。
b. 在整个外泌体分离纯化过程中,纯化柱的顶部筛板必须始终保持湿润,否则影响外泌体分离效果。
c. 需要向纯化柱中加入大体积溶液时,可以将适配器与纯化柱连接,将溶液加入到适配器中。
d. PBS推荐新鲜配制并经0.2 μm滤膜过滤,或采购商业化无菌的PBS,避免微生物或颗粒物污染。PBS溶液使用前,必须平衡到室温,否则纯化柱中可能出现大量气泡,影响外泌体分离效果。
3. 分离外泌体
1) 样品上样。移除纯化柱中的PBS,在上方加入3 mL样本;样本不足3 mL,可用PBS补至3 mL,混匀后上样。取下纯化柱底部密封帽,等待样本全部进入纯化柱内后,再加PBS;
a. 如果样品体积超过3 mL,建议试用50 kDa超滤管浓缩样品至3 mL,注意浓缩体积不超过20倍。超滤浓缩方法详见超滤管的说明书。
b. 对于高粘度样本,如血浆、血清、高粘度胸腹水等样本,可取1.5 mL样本,用PBS稀释至3 mL,混匀后上样。
c. 必须待样品全部进入筛板后,再加入PBS,避免样品被稀释影响分离效果。
2) 外泌体分离。先在纯化柱下方准备好1.5mL离心管,然后在纯化柱上方加入1 mL PBS。待下方收集到1 mL馏分后,可加下一次1 mL PBS,换新的1.5 mL离心管收集。根据流出顺序分别标记馏分管编号。
3) 外泌体收集。收集8、9、10、11、12号馏分管即可获取外泌体,其中9、10、11号馏分管的外泌体浓度更高。收集液可直接测定外泌体颗粒数和蛋白浓度。
4) 外泌体浓缩。测定收集外泌体的颗粒浓度和蛋白浓度,根据后续实验要求,决定是否对外泌体收集液进行浓缩。如浓缩,建议使用MWCO 50 kDa的超滤管,4000 g离心浓缩到目的体积即可。
4. 纯化柱维护
1) 收集完所有馏分后,将适配器与纯化柱连接,并从顶部加入至少2倍柱体积(60 mL)PBS清洗纯化柱,至下方没有溶液流出。
2) 再加1.5倍柱体积(45 mL)的20%乙醇清洗纯化柱,至下方没有溶液流出。
3) 最后取下适配器,向纯化柱中加入5 mL 20%乙醇的封闭液,安装纯化柱顶盖,然后在密封帽中充满20%乙醇,盖到纯化柱下端出口,置于4℃直立保存。
操作注意事项
1. 新购买或使用后的纯化柱,上筛板和白色琼脂糖微球之间可能会出现一定的空隙,这是储存和使用过程中凝胶沉降造成的,并不影响纯化柱的性能,将上筛板向下推至无空隙即可正常使用;
2. 纯化柱保存在封闭液中,封闭液为20%乙醇。20%乙醇建议现配现用,同时经0.2 μm滤膜过滤、超声或真空脱气,避免造成纯化柱出现大量气泡,影响分离效果;
3. 每次纯化柱使用前需要使用无菌并平衡至室温的PBS清洗。PBS建议现配现用,同时经0.2 μm滤膜过滤、超声或真空脱气,避免造成纯化柱出现大量气泡,影响分离效果;
4. 纯化柱中间不能有气泡,使用前后需认真检查,避免影响实验;
5. 纯化柱可以反复利用,但是多次使用会影响效果,建议重复使用不超过5次;
6. 当分离的外泌体进行NGS或者其他组学分析时,为避免交叉污染,建议每个样品使用一支新的纯化柱。
FAQs
Q:{{item.question}}
A: