必备实验技能之——手把手教你细胞计数
来源:Pricella 发布时间:2019-06-21 16:00:28
在细胞培养中,细胞计数是一项基本功,遥想当年,刚刚进入实验室开始做细胞实验时,最让小编头疼的就是给细胞计数了,虽然比较简单,但是经常晕头转向、数到眼瞎,而且万一一个不小心被其他人打断了思路,分分钟前功尽弃。
其实,之所以觉得数细胞如此辛苦,很大一部分原因是还没有掌握细胞计数的正确操作,当仪器对细胞计数分类出现异常时,手工显微镜检查就显的尤为重要。下面小编给大家总结下细胞计数的详细步骤的方法,供大家参考。
1,首先准备好细胞计数器(血球计数板)
使用70%乙醇将盖玻片和细胞计数板清洁、晾干备用。
将晾干的盖玻片轻轻覆盖至血细胞计数器上。
(注:使用前须保证盖玻片和计数板已充分晾干,否则将影响后续细胞充池及计数结果。)
2,制备细胞悬液
对于贴壁生长的细胞,我们需要首先使用胰酶消化的方法使细胞从培养皿表面脱落。(悬浮细胞则无需消化,稀释到合适倍数即可。)
然后加入适当的含血清培养基,中和胰酶的作用并重悬细胞,以得到均质的细胞悬液。要求尽可能将细胞吹散,不要残留任何细胞团,但不可用力过大。
(注:消化太过或消化不全均会使计数结果产生偏差。)
台盼兰染色(可选):
如果需要计算细胞的活率,则需要将细胞悬液和0.4%台盼兰等体积混合;
室温孵育3-5分钟(悬浮细胞染色时间可视情况适当延长),使台盼兰完全进入死细胞,使死细胞着蓝色。
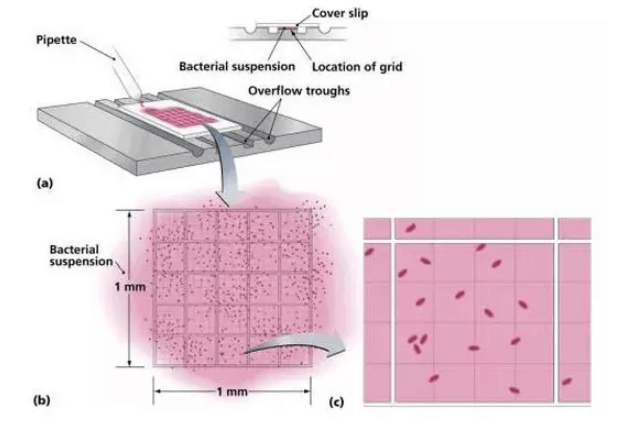
3,血细胞计数器加样
使用吸管或移液器将细胞悬液或细胞/台盼兰混合液滴加到计数池的边缘。此时液滴将在虹吸的作用下进入盖玻片下方的计数池,此即为充池。
(注:若需进行多个样品的计数,应尽量保证每次充池的体积一致,一般在10μl/池左右。)
以同样的方式在另一侧的计数池中也加入计数样品。
将计数板静置几分钟使细胞扩散、沉降。
4,细胞计数
在100倍显微镜下,移动计数板将视野对准计数板的中央大方块,该方块四周有一圈3条平行线包围,中间有密集的网格。中央方块区差不多刚好可以填满整个视野(下图标记的3号位置)。

分别计数大方格1.2.4.5中的细胞数。(为降低计数误差,最好将细胞浓度调整为20-50个/大方格。)并重复记录另一侧计数池中的细胞数,总计8个大方块,然后取均值。
计数原则为:“数上不数下,数左不数右”。(判断标准为是否接触三条边线的中间线,如下图所示)

如果有多个细胞没有吹散而成团存在,此时只可记为一个细胞。如果团块很多,则需重新吹打甚至重新取样消化直至绝大多数细胞为单个细胞。
5,细胞浓度

由上图可以得出,每个大方格的容积为:
1 mm2×0.1 mm = 0.1 mm3 =10-4 cm3= 10-4 ml
即每个大方格的容积为万分之一毫升,因此在计算每毫升液体中的细胞数时需乘以104。
在常规没有使用台盼兰染色时,可以以下面公式计算每毫升样品中细胞的个数:
每毫升样品中细胞的个数 = 每个大方格内细胞的平均数 × 细胞稀释倍数×104
如果使用了台盼兰染色,还需要计算活细胞的百分率:
活细胞百分率(%)= 台盼兰拒染细胞数/总细胞数×100
此时活细胞数的计算公式为:
每毫升样品中活细胞的个数 = 每个大方格中细胞的平均数×活细胞比率×细胞稀释倍数×2×104
注:乘2是由于在台盼兰染色时,进行了等体积混合,相当于稀释了一倍。
看了以上步骤和原理,大家不禁会问:我们为什么要数细胞啊?细胞计数究竟有什么意义呢?其实,当我们想了解细胞的生长情况时,除了直接观察细胞形态以外,绘制细胞生长曲线、计算细胞倍增时间应该就是广泛采用的评价指标了。
所以尽管使用血细胞计数板手工计数细胞过程十分繁琐,对实验者操作者的要求也比较严格,现在也已有很多自动化的细胞计数器/仪,但对于科学研究中遇到的各种细胞而言,手工计数仍然是最简便易行的方法而被广大实验室采用。
